Bu yılın Nobel Kimya Ödülü “üstün çözünürlüklü mikroskopi”ye katkılarından dolayı Stefan Hell, Eric Betzig ve William Moerner’e verildi. İyi ama üstün çözünürlüklü de ne demek?

İnsanlar mikroskopik boyuttaki nesneleri gökyüzündekiler kadar merak etmemiş olacaktı ki mikroskobun gelişimi teleskobunkine göre biraz daha zaman aldı.
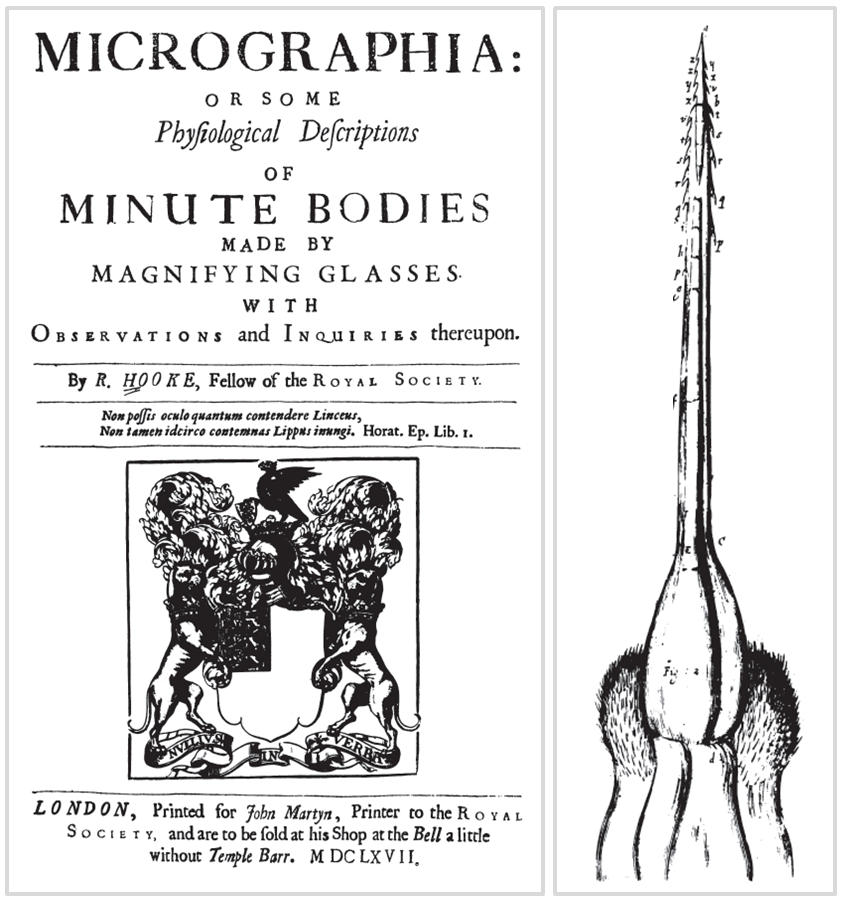
Hollandalı Anthony van Leeuwenhoek ve İngiliz Robert Hooke mikroskobun kullanımına öncülük ettiler. Hooke, mikroskop ile incelediği cisimleri çizerek belki de ilk bilimsel “çoksatar”a imza attı (Şekil 2). Bir şişe mantarının mikroskop görüntüsü ona manastırlarda rahiplerin kaldığı hücreleri hatırlattığından gördüklerine “hücre” adını verdi. Bugün bu terimi bilmeyen kalmadı gibi.
Ama tabii mikroskoplar sihirle değil, fizik kanunlarıyla işlediğinden elde edilen görüntüler mükemmel değildi. İlk sorunlardan biri, mikroskopun merceklerinden geçen beyaz ışığın renklerine ayrılması, dolayısıyla aynı noktaya odaklanamamasıydı. Dolayısıyla incelenecek nesnedeki herhangi bir noktadan gelen ışınlar, gözde tek bir noktaya değil de birkaç noktaya birden dağılıyor, değişik noktaların ışınları birbirlerine karıştıkça görüntünün keskinliği azalıyordu. “Renk sapması” denen bu sorun ancak uzun zamanda mercek teknolojisi sayesinde aşılabildi.
Bu esnada Alman fizikçi -ve sanayici- Ernst Abbe, bir mikroskopla ne kadar küçük nesnelere bakılabileceğini inceliyordu. Hesaplarına göre bir mikroskopla görülebilecek en küçük nesnenin boyutu kullanılan ışığın dalga boyunun yarısı kadardı. Görülebilir ışığın dalgaboyu 390-700 nanometre arasında olduğuna göre yaklaşık 200 nanometreden daha küçük nesneleri birbirinden ayırt etmek ışık mikroskobuyla mümkün olmayacaktı. Buna “Abbe sınırı” dendi.
![Şekil 3. Değişik biyolojik nesnelerin büyüklüklerinin Abbe sınırıyla mukayesesi (Huang, Babcock ve Zhuang’ın [2010] makalesinden değiştirilerek Türkçeleştirilmiştir.)](http://www.acikbilim.com/wp-content/uploads/2014/11/abbesiniri.png)
Ama elektron mikroskopu her iş için kullanılamıyordu. Bir kere, pahalıydı. Ayrıca incelenecek numunelerin çok çetrefilli bir hazırlık işleminden geçmesi gerekiyordu. Görüntülemenin yapıldığı havasız ortam, bazen biyolojik numuneleri olumsuz etkiliyordu.
Ayrıca 20. asrın sonuna doğru, o kadar yüksek çözünürlükte olmasa da ışık mikroskobuyla çok yararlı, yeni yöntemler geliştirilmişti ve elektron mikroskopları bu konularda işe yaramıyordu. Mesela, hücre içindeki belirli proteinlere genetik yöntemlerle “parıldayan” proteinler iliştiriliyor ve karanlık odada, lazer ışınları altında parıldatılan bu proteinlerle canlı hücrelerden görüntüler elde ediliyordu. Örneğin aşağıdaki videoda, bir hücre bölünmesi sırasında kofulların (yeşil) dağılımını izleyebilirsiniz:
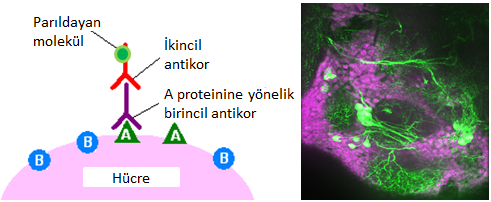
Ya da, hücredeki proteinler, onlara özgü antikorlar ve “parıldayan” boyalarla boyanıp yine karanlık odada lazerlerle inceleniyordu. Antikorlar, vücudun yabancı cisimlerin proteinlerine karşı ürettiği, özgül olarak o proteinlere bağlanabilen özel proteinlerdir. Bilim insanları bu özgül bağlanma özelliğinden şu şekilde istifade etttiler: İstedikleri proteinlere bağlanan antikorları ürettiler, sonra ellerindeki numunelerdeki proteinlere bu antikorların bağlanmasını, sonra da bu antikorlara bağlanan başka antikorların bunlara bağlanmasını sağladılar (Şekil 4). Yalnız bu ikinci antikorlar ayrıca parıldayan bir boya taşıdıklarından lazer altında görülebiliyordu.
Üstelik yeni “eşodaklı” mikroskoplar sayesinde kalın numuneleri gerçekte dilimlemeden onlardan kesitler almak da artık mümkündü (Şekil 4).
Sıra bunun çözünürlüğünü artırmaya gelmişti. Birbirine 200 nanometreden daha yakın iki parıldayan molekül birbirinden nasıl ayırt edilecekti? İşte bunun cevabını bulan 3 araştırmacı bu yıkın Nobel Kimya Ödülü’nü aldı: Parıldayan molekülleri aynı anda değil, ayrı ayrı parıldatacak ve saptayacaklardı. Buna “üstün çözünürlüklü mikroskopi” dendi.
Bu amaçla birden fazla yöntem geliştirildi. Bunların ayrıntısına burada girmeyeceğim, ama birbirlerine göre değişik avantajları ve dezavantajları olduğunu söylemekle yetinebilirim. Dolayısıyla araştırmacıların kendi deneylerine ve şartlarına uygun yöntemi seçmeleri gerekiyor.
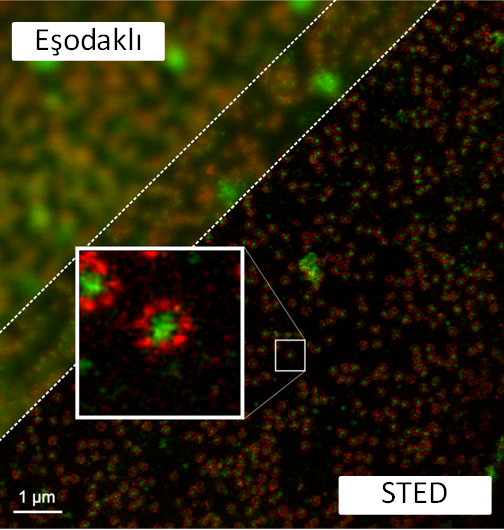
Bu yöntemlerden birinin adı STED. Aşağıdaki şekilde sol-üstte, eşodaklı bir mikroskopla elde edilmiş görüntüyü, sağ-altta ise aynı numunenin STED ile elde edilmiş görüntüsünü bulabilirsiniz. Bu numunede hücrenin çekirdeğindeki kimi proteinler kırmızı ve yeşile boyanmış. Eşodaklı mikroskoptan elde edilen görüntü bir hayli flu. STED ile elde edilen görüntü çok daha net.
Ama geliştirilecek çok şey var. Şu anda görüntülemede yüksek çözünürlük, hassasiyet ve hız aynı anda sağlanamıyor. Görüntünün çözünürlüğü artırıldı ama zaman çözünürlüğü hala istenen düzeyde değil. Halbuki özellikle hücre içindeki olayların videolarının elde edilebilmesi için aynı görüntünün uzun süre ve sık aralıklarla elde edilmesi gerekli, ama bu henüz pek mümkün değil. Nobel Ödüllü bilim insanlarının açtığı sahanın yelken çevirdiği yön şimdi de bu.
Kaynaklar
- M. Bragg, 2013. In Our Time: The Microscope. BBC Radio 4
- M. Ehrenberg, 2014. 2014 yılı Nobel Kimya Ödülü bilimsel açıklaması. Nobel Ödülü web sitesi
- V. Marx, 2013. Is superresolution microscopy right for you? Nature Methods 10: 1157

Yorum Ekle